《中国制药行业深度分析及“十五五”进展规划指导报告》指出,2023年全球制药市场规模达到75.36亿元,预计到2029年市场规模将会达到180.4亿元。
对于医药产业而言,新药研发是促进医药行业不断进步的支撑力量。随着人口老龄化的加剧,新兴市场(如中国、印度等国家)的医疗支出日益增长、中产阶级对高质量医疗服务的需求日益增强,为医药市场提供了庞大的需求空间,因此制药公司纷纷加大研发投入,加速新药上市进程,以期在激烈的市场竞争中脱颖而出。
17种新治疗方案获EMA批准
2024年12月,欧洲药品管理局的人用医药产品委员会(CHMP)建议批准17种新药,包括默克公司的肾癌药物Welireg、拜耳和BridgeBio的转甲状腺素淀粉样心肌病(ATTR-CM)新药acoramidis,以及吉利德用于治疗原发性胆汁性胆管炎(PBC)的 seladelpar等。
Welireg:
此次CHMP的批准是基于Ⅱ期LITESPARK-004试验和Ⅲ期LITESPARK-005试验的肿瘤缩小数据,以及在后一项试验中Welireg的无进展生存期超过了诺华的Afinitor。然而,尽管趋势良好,但-005试验的最终分析里并未发现Welireg在透明细胞肾癌中的总体生存获益上具有统计学的意义。
Acoramidis:
今年早些时候,拜耳向BridgeBio支付3.1亿美元获得了acoramidis在欧洲的销售权,成为辉瑞tafamidis特许经营权的直接竞争对手。若欧盟委员会若通过几种药物正式的销售权,acoramidis将以Beyonttra品牌销售。
CHMP在其总结中也提到了Beyonttra在复合终点上的改进。拜耳表示,欧盟委员会的最终决定预计将在未来几个月内做出,并计划于2025年上半年在欧洲推出Beyonttra。
Seladelpar:
今年,吉利德以43亿美元收购了CymaBay Therapeutics,从而获得了Seladelpar,并于8月获得FDA批准,并在欧盟委员会撤销先前授予Intercept和Advanz Pharma这两家企业的 Ocaliva的销售权后得到CHMP的积极意见。
Alofisel:
说到退出市场,武田已决定将其用于治疗克罗恩病复杂肛瘘的Alofisel从欧盟市场撤出。一年多前,在一项ADMIRE-CD II 的Ⅲ期试验中,发现干细胞疗法效果并不比安慰剂更好。今年2月公布的其他试验结果再次显示,两种疗法在任何次要终点上都没有统计学上的差异。
武田药品公司美国业务部和全球投资组合商业化总裁Ramona Sequeira在周五的一份声明中表示:武田与EMA、医学专业人士和其他利益相关者就围绕Alofisel的全部数据进行了数月的讨论。“这些讨论表明,尽管我们的数据结果相互矛盾,但Alofisel的临床获益不再足以证明其在欧盟市场中继续销售的合理性”Sequeira说。
其他药物意见:
除了这些决定外,关于礼来公司将Mounjaro的标签扩大到肥胖患者的阻塞性睡眠呼吸暂停的申请,药物审查员认为,Mounjaro现有的体重管理适应症已经涵盖了这种用途,不需要再单独提出。同时推荐了礼来的Omvoh用于克罗恩病,勃林格殷格翰的Ofev用于治疗6岁以上儿童进行性纤维化间质性肺病。
2024国内新药审批捷报频传,多款新药成功获批
近年来,以2019年《药品管理法》颁布为标志,我国药事管理上一系列的优化政策极大地促进了中国医药产业的发展。在2024年,国内在新药研发方面也取得了显著进展,多家药企的产品成功通过NMPA审批,为医药市场的创新发展注入了新的活力。如上海科州出品的全球首个治疗NRAS突变晚期黑色素瘤的MEK抑制剂妥拉美替尼胶囊;迪哲医药的全球首个治疗外周T细胞淋巴瘤的JAK抑制剂;北京浦润奥生物的首个国产治疗MET异常脑胶质瘤的靶向药物伯瑞替尼肠溶胶囊;圣和药业的适用于非小细胞肺癌一线治疗的甲磺酸瑞厄替尼片;金赛药业的适用于儿童生长缓慢的聚乙二醇重组人生长激素注射液等等新药。
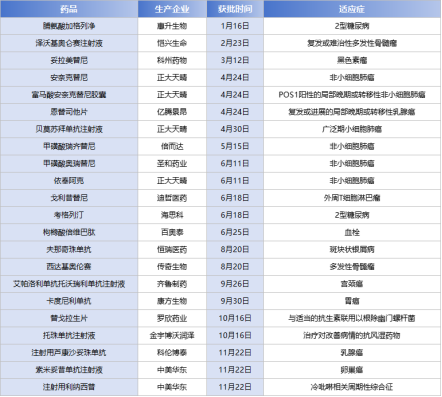
(仅展示部分2024年通过NMPA审批的药品)
这些新药的获批,不仅体现了国内药企在研发创新方面的实力,也反映了国家药品审批制度的不断完善和优化。随着医药行业的快速发展和政策的持续支持,相信未来会有更多优质、高效的药品通过审批,为患者带来更多的福音。