验证是药品生产质量管理规范(GMP)的重要支柱之一,是保障药品安全性、有效性和质量可控性的重要手段。中国国家药监局加入PIC/S已成定局,其影响并不只针对出口型企业,而是国内所有制药企业的监管要求都会更加严格,并与国际看齐。在即将实施最新中国GMP无菌附录的背景下,企业验证工作如何与国际主流验证实践接轨成为国内制药行业同仁的重要任务与挑战。正是基于验证的重要性,上海信销信息科技有限公司携手业内资深药事法规专家 瓴荟智库中心专家徐禾丰老师,组织翻译了验证领域的“圣经”——《制药工艺验证手册(第四版)》(Handbook of Validation in Pharmaceutical Processes),助力我国制药行业同仁更深入理解并学习国际先进验证方法与实践经验。
 书籍简介:
书籍简介:
《制药工艺验证手册(第四版)》由美国CRC出版社于2022年出版,本书共计67个章节,是基于FDA 2011版、欧盟、WHO、PIC/S等发布的验证指南编纂而成。对于药品研发、生产、监管等环节的验证工作具有极高的参考价值。
编辑团队:
l詹姆斯·阿加洛科(James Agalloco)是阿加洛科联合公司的总裁。曾担任百时美施贵宝的全球验证与自动化技术总监、注射剂协会的前任主席,在2006年至2025年期间为美国药典(USP)微生物学与无菌保证专家委员会的成员。
l菲尔·德桑蒂斯(Phil DeSantis)是一位拥有50多年制药行业经验的制药顾问。他曾担任注射剂协会(PDA)科学顾问委员会主席,并经常为PDA、ISPE、FDA担任讲师。
l安东尼·格里利(Anthony Grilli)是焦点实验室总裁。凭借超过25年的合同实验室经验,帮助了数百个公司通过各种微生物验证与修复问题。他已成功主持了数十次(美国)食品与药品监督管理局(FDA)与数百次客户审核。
l安东尼·帕维尔(Anthony Pavell)是 Fresenius Kabi USA Grand Island 纽约工厂的工厂经理。曾在注射剂协会(PDA) 工作组任职,拥有超过 25 年的生产运营、产品技术转移和新设施流程等方面经验。 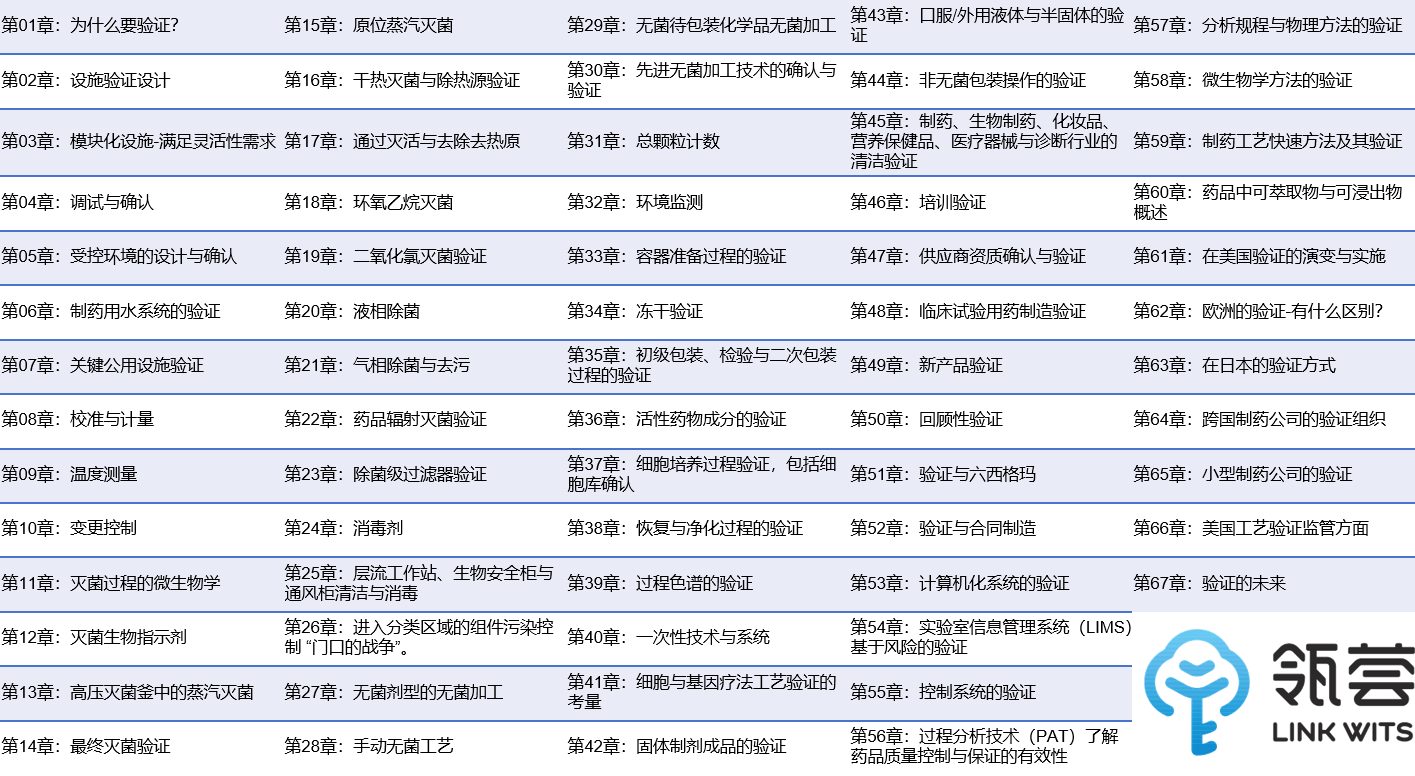
主译简介:
徐禾丰——沈阳药科大学毕业,在制药行业从业近40年,系统掌握了欧、美等高端医药市场的药品注册文件编写,在欧、美药政法规,GMP实践、实验室管控、验证、风险分析等领域均有很深的造诣及研究。
曾多次为GMP检查员、各省药监机构与制药企业进行培训。多年前开始关注欧盟GMP动态,对欧盟GMP相关的指南、技术报告、标准与应用进行了专门研究。2012年组织翻译并出版了《Validation of Pharmaceutical Processes》(制药工艺的验证)第三版,此书被众多业内同仁研习,并在实际工作中加以应用与参考,对我国药品验证领域产生了深远影响。

如何购买:长按并识别下方二维码

上海信销信息科技有限公司拥有本书中文翻译出版独家版权!
目前出版工作火热进行中,预计2025年8月正式出版!
定价:280元
惊喜预售价:8.8折 245元

活动说明:
活动时期:截止日期2025年2月1日
发货说明:预计2025年8月正式出版后,陆续发货
发票说明:开票请联系信销侯亚杰 18567215982(同微信),可在确认收货后,收到我方提供的电子版增值税普通发票。
批量购书请联系:信销侯亚杰 18567215982(同微信)
出版合作请联系:信销王风云 13162350854(同微信)