近期,美国食品和药物管理局(U.S. Food and Drug Administration)宣布,打算扩大食品、药品等国外生产制造商的飞行检查。这对于药企而言,具有一定的挑战。

为帮助中国企业迎检,信销行研统计分析了近5年FDA公开发布的483检查报告结果,重点分析了缺陷类别,以便企业了解FDA检查的关注重点及常见缺陷,助力企业顺利过检。
未制定和遵守书面程序,成为缺陷重灾区
根据FDA公开发布的483报告显示,2019-2025年,前十项缺陷分别是未编写或遵守书面流程;未进行差异/故障调查;无科学的实验室控制程序;设备清洁、消毒、维护不到位、设备设计、规格和位置不当;无计算机控制程序;药物放行前未进行实验检测;无菌药品操作程序不合规;无程序监测和验证过程控制;设备未校准/检查/检验。
未编写和遵守操作流程这一项缺陷占比高达14.67%,另外还需关注与设备相关的风险,总体缺陷占比高达6.96%。
2019-2025年FDA发布483内容,飞检缺陷TOP10分析
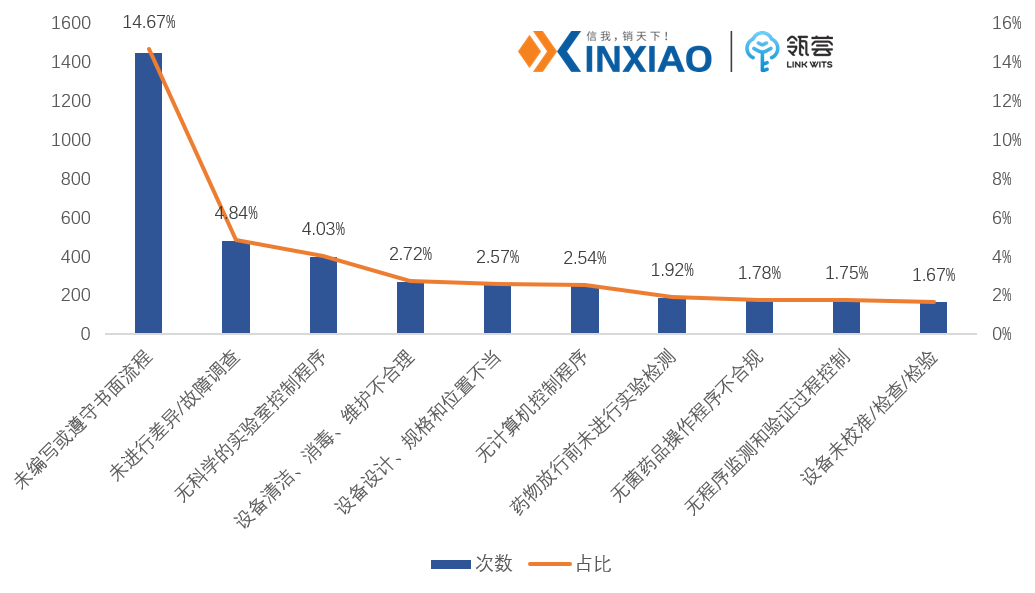
数据来源:FDA官网,信销行研整理
除此之外,信销行研统计了1756家FDA检查的药企情况,其中平均缺陷数量呈现下降的趋势。尤其是2025年以来,每个企业的缺陷平均只有3.62项,较2024年有较大幅度的下降。
2019-2025年FDA发布483内容,飞检缺陷数量分析
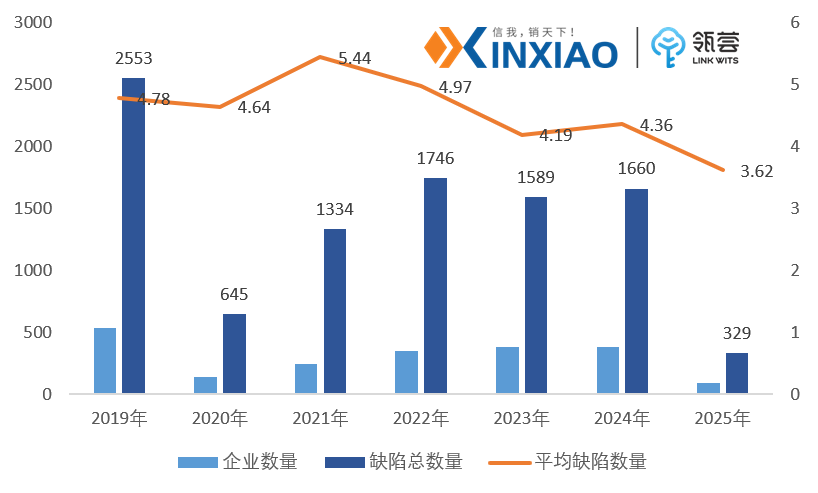 数据来源:FDA官网,信销行研整理
数据来源:FDA官网,信销行研整理
企业应对之策:做好随时迎检准备,引入第三方预检查模拟
以前,FDA的国外检查都是会提早通知,今后将实行无预警的飞行检查,对于迎检企业,挑战瞬间提升了好几个层级。这就意味着企业需要随时做好接受FDA检查的准备。
具体而言,企业可以从以下方面着手提升。
及时自查自纠。企业需要按照合规性要求,全面开展自查自纠,针对FDA公布483内容的缺陷重点概率方向要进行全面的盘查。尤其是对于偏差记录、CAPA报告,做好回顾分析与调研。
日常合规,避免突击整改迎检。加强员工的培训和监督,尤其是做好内部培训,在有必要的情况下,还可聘请企业外的专家以第三方视角,对企业员工进行培训。
日常操作严格按照SOP流程执行,做好真实的数据记录,将合规注入每个员工、每个岗位的日常工作中,保持生产现场清洁、环境风险可控,避免临时突击整改。
文件准备充分和语言沟通流畅。还要做好相关中英文对照的文件或储备专业的翻译人员,以规避在检查过程中由于语言不畅产生的沟通偏差。
引入第三方检查模拟。外部的检查专家可以多角度,多思路看待企业日常的规范管理。在模拟过程中还可以询问员工一些专业性的问题,模拟挑战一些数据或者操作的准确性,以便所有人在正式检查过程中简洁、明确的回复问题。
通过演练,及时发现问题,解决问题,提升员工的应对能力,从而做到万无一失,规避FDA飞行检查的风险。
加强设备管理及供应商审计。随着自动化、智能化设备在各企业的使用,设备对于药品质量安全的保障权重越来越高,定期预维修、防护、验证、校对设备的状态显得尤其重要,确保设备校准、维护记录完整,状态标识清晰。
除此之外,我们更应该在药品的全生命周期过程中加强设备合理性的项目审评、设备供应商的审计管理,最大限度降低设备给药品生产引入的风险。
GMP合规是企业的底线,提升无止境,希望每家企业都能达到随时做好被检查的准备。
如果企业目前在GMP方面还有所欠缺,可以马上行动起来。瓴荟智库中心拥有众多FDA、EMA过评项目经验的生产、质量等管理方面的专家,同时也有经验非常丰富的药监局资深检查员可为您提供帮助。如有项目需求外审检查及培训,敬请垂询。
