2025年5月29日,中国医药行业呈现戏剧化的双重画面:一方面,国家药监局集中批准了11款创新药上市,创下历史纪录,彰显了中国医药创新的蓬勃活力;另一方面,曾主导中国药审改革的关键人物毕井泉被中央纪委国家监委宣布调查,引发了行业热议。
这两个看似不相关的事件,实则有可能勾勒出中国创新药发展历程中的成就与挑战、发展与阵痛。
本文将从中国创新药的发展历程、当前成就、改革政策等方面剖析中国近年医药创新发展概况,揭示在政策推动、资本助力、人才集聚等背景下,中国如何从仿制药大国向创新药强国迈进。
创新药集中获批,屡创新高
5月29日,国家药品监督管理局(NMPA)集中发布了11款创新药的上市批件,覆盖了肿瘤、罕见病、儿童用药等多个临床急需领域,可谓"创新药集体大爆发"。
截至5月29日,国家药监局就1类创新药已批准了36个(完整创新药名单,可文末留言获取),呈现井喷态势,意味着中国医药创新进入收获期。
2019-2025年获批创新药情况
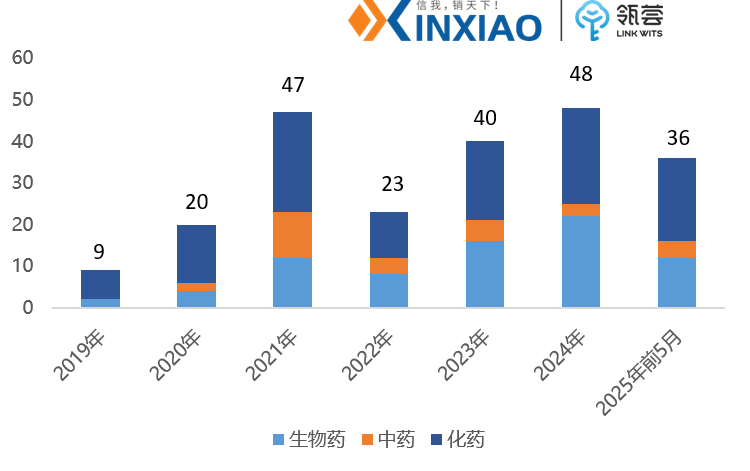
数据来源:国家药监局,仅统计1类创新药,信销行研整理
其实,当前创新药在中国所取得的成果,与毕井泉在2015-2018年担任原CFDA局长期间,推动的一系列医药改革措施紧密相关,包括解决审评积压、开展临床试验数据自查核查、推进仿制药一致性评价、引入药品上市许可持有人制度(MAH)等。因此,他也曾被认为是中国创新药"黄金时代"的开创者。
中国创新药发展历程回顾
中国创新药的崛起并非一蹴而就,而是经历了漫长而曲折的演进过程。这段历程大致可以分为四个阶段:萌芽期(2005年之前)、改革初期(2005-2015年)、黄金发展期(2015-2020年)和高质量发展期(2020年至今),每个阶段都有其鲜明的特征与标志性事件。
中国创新药发展历程四个主要阶段
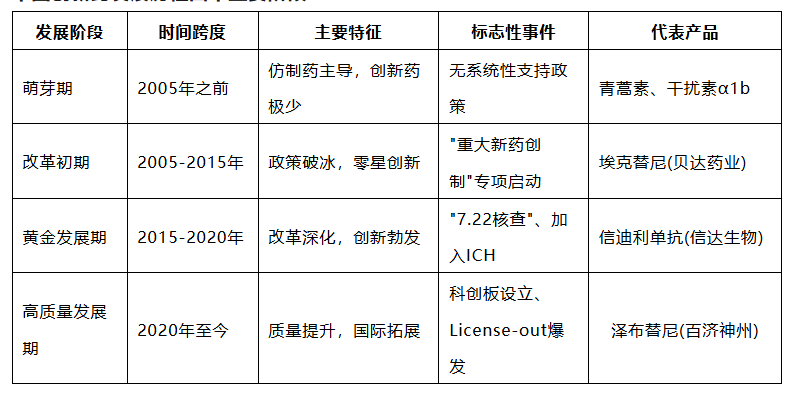
萌芽期:创新荒漠与仿制药主导(2005年之前)
21世纪初期,中国医药市场几乎是仿制药的天下,本土创新药几乎是一片荒漠。2005年之前,中国自主研发的一类新药屈指可数,较为知名的仅有青蒿素类抗疟药、注射用重组人干扰素α1b(赛若金)等少数几个品种。这一时期,国内制药企业普遍缺乏创新动力与能力,药品研发投入极低,大多数企业满足于生产低水平重复的仿制药,通过"改剂型、改规格"等微创新手段获取批文。
改革初期:政策破冰与体系构建(2005-2015年)
2005年前后,随着中国经济实力增强和医疗需求升级,政府部门开始意识到医药创新的重要性,一系列政策破冰举措陆续出台。
2008年,国家"重大新药创制"科技专项启动,投入数百亿元支持新药研发,这是中国政府首次大规模系统性支持医药创新。与此同时,药监部门开始尝试改革审评审批制度,提高标准,加快创新药审评速度。
黄金发展期:改革深化与创新勃发(2015-2020年)
2015年是中国创新药发展的关键转折点,被公认为中国医药创新的"元年"。毕井泉出任原国家食品药品监督管理总局局长,开启了一系列影响深远的改革。7月,原国家食药监局发布《关于开展药物临床试验数据自查核查工作的公告》,史称"7.22核查",要求申请人对已申报生产或进口的待审药品注册申请药物临床试验情况开展自查,结果85%的申请主动撤回,89%的申请最终被撤回或不批准。一举解决了长期存在的临床数据造假问题,为后续改革扫清了障碍。
2015年8月,国务院发布《关于改革药品医疗器械审评审批制度的意见》,正式拉开药审改革大幕。此后几年,一系列配套政策密集出台:2016年《关于解决药品注册申请积压实行优先审评审批的意见》建立优先审评通道;《关于开展仿制药质量和疗效一致性评价的意见》提升仿制药质量;药品上市许可持有人制度(MAH)试点打破"捆绑"生产与研发的桎梏。2017年,中国加入人用药品注册技术要求国际协调会议(ICH),标志着中国药品监管体系开始与国际接轨。
政策红利释放的同时,资本与人才加速向创新药领域集聚。2018年港股推出18A政策,允许未盈利生物科技公司上市;2019年科创板开板,为创新药企提供了新的融资渠道。大批具有国际药企工作经验的科学家回国创业,百济神州、信达生物、君实生物等一批创新型生物科技公司如雨后春笋般涌现。这一时期,中国创新药IND(新药临床试验申请)数量呈现爆发式增长,从2010年到2023年翻了约28倍。
高质量发展期:转型升级与国际拓展(2020年至今)
进入2020年代,中国创新药行业开始从高速增长阶段向高质量发展阶段转型。一方面,创新成果不断涌现,中国新药上市数量持续增长;在研新药管线数量仅次于美国,位列第二。
2024中国药物研发管线占比26.7%,仅次于美国
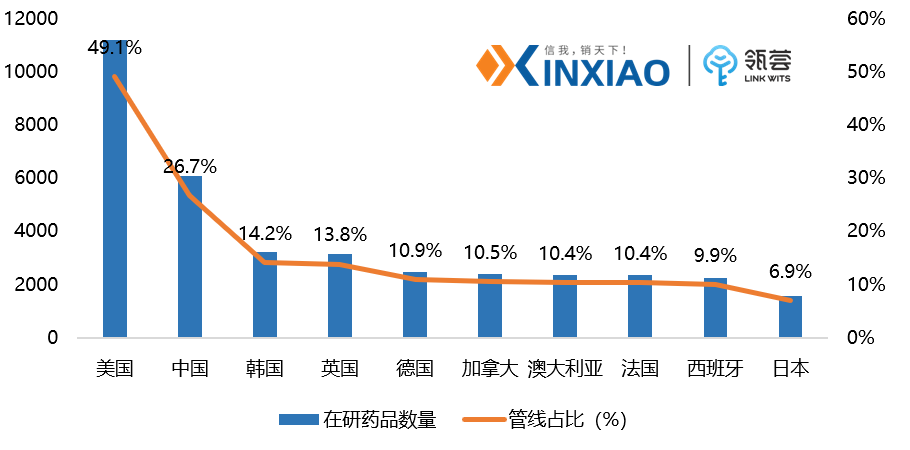
数据来源:《2024医药研发年报回顾》,信销行研整理
另一方面,中国创新药的国际地位发生了根本性变化,从过去的技术引进方转变为重要的成果输出方,License-out(对外授权)交易近年呈现爆发式增长,部分创新药企通过License-out(对外授权)、自主出海、Newco等多种形式走向国际舞台。
2016-2024年国内医药企业对外许可交易情况
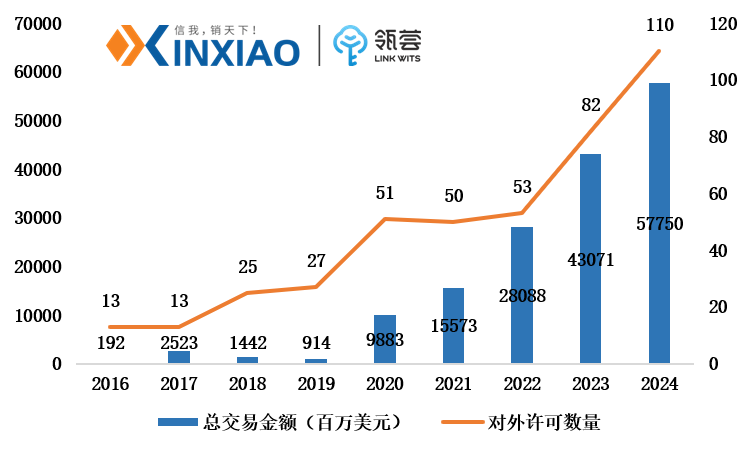
数据来源:公开渠道,信销行研整理
纵观中国创新药的发展历程,从几乎空白到全球第二,跨越式发展背后是多方合力的结果:政策改革破除制度障碍,资本市场提供资金支持,人才回归带来技术能力,企业转型形成创新主体。
特别是2015年药审改革以来的加速追赶,已经取得了令人瞩目的成就。从全球视野审视,中国创新药已经实现了从"跟跑"到"并跑"的转变,在部分领域甚至开始"领跑"。
2025年5月,三生国健及其关联方将PD-1/VEGF双特异性抗体SSGJ-707的全球(不包括中国内地)独家权益授予辉瑞,首付款达12.5亿美元,潜在总金额最高可达48亿美元,创下国产创新药出海首付款金额的历史新高。
最后的话
2015-2018年期间,是创新药飞速发展的关键时期,毕井泉时任原国家药监局局长,后因吉林长春长生公司问题疫苗案件引咎辞职,此次其被纪检委公开披露,涉嫌严重违纪违法,不免令人有些唏嘘。
如果他在药监系统任职期间的所作所为涉及违纪违法,不免让医药同仁对于未来医改政策的连续实施和改革成果的巩固有些担忧。