近日,某药企发布公告称,公司收到美国FDA发出的警告信。主要指出了三大核心缺陷:部分口服固体生产设备的清洁管理不规范、无菌生产区域的维护不到位以及压片剔废参数研究不充分。
值得注意的是,这已是该药企历史上第三次遭遇FDA的严重合规警示,前两次分别发生在2018年和2024年。
除了以上药企外,国内其他知名企业也曾收到FDA的警告信。这也揭示了一个残酷的事实:中国药企在"走出去"的过程中,仅靠硬件投入和规模扩张是不够的,必须同步提升质量文化和管理体系的成熟度,也折射出中国制药行业在国际化进程中面临着合规性挑战。
每一个药企人需要对合规心存敬畏,迎检时的应急整改保证不了药品的长期质量合规。
尤其值得关注的是,清洁验证已经成为483报告和警告信中指出的常见缺陷。本文就如何避免清洁验证缺陷展开深入分析。
欧盟、美国、中国对于清洁验证的要求及实施重点解析
根据《药品生产质量管理规范(2010 年修订)》附录《确认与验证》对清洁验证规定了含义,即:有文件和记录证明所批准的清洁规程能有效清洁设备,使之符合药品生产的要求。
欧盟GMP附录15《确认与验证》是清洁验证的核心法规依据,其中明确规定:"清洁验证应当证明清洁方法能够有效去除产品残留、清洁剂残留和微生物污染,将交叉污染风险降至可接受水平"。
2025年1月,欧盟对GMP附录15进行了修订,进一步强化了清洁验证生命周期管理的要求,将整个过程分为设计、验证和持续确认三个阶段。
2024年,欧盟还发布了《清洁验证指南》,详细规定了基于健康的暴露限值(HBEL)的确定方法。
美国清洁验证涉及的法规《21 CFR Part 211(cGMP)》和《清洁工艺验证检查指南》等文件体现了FDA对清洁验证的严格要求。FDA高度重视清洁验证中书面程序的编写及执行。
FDA检查官员对于清洁验证的关注重点图示

图片来源:网络,如侵请联系删除
中国GMP(2010年修订)附录《确认与验证》是中国清洁验证的基础法规,其中第38条至49条专门规定了清洁验证的基本要求。
2025年1月,国家药监局核查中心发布的《清洁验证技术指南》标志着中国清洁验证监管进入精细化阶段,系统阐述了清洁验证生命周期管理的理念和方法。
文件链接:https://www.cfdi.org.cn/cfdi/resource/news/16299.html
清洁验证缺陷导致的污染风险
没有充分清洁的设备可能导致活性成分残留、微生物污染或交叉污染,直接影响药品的安全性和有效性。
更令人担忧的是,如果清洁程序的制定缺乏科学依据,清洁效果的验证不充分,清洁记录的完整性也无法保证。那么企业将无法证明其生产设备在批次间的清洁是充分且一致的,从而无法排除生产药品发生污染的可能性。
同时,我们需要清晰的从污染源、污染物、途径、工序等方面考虑,充分认知清洁验证发生缺陷可能带来的风险。
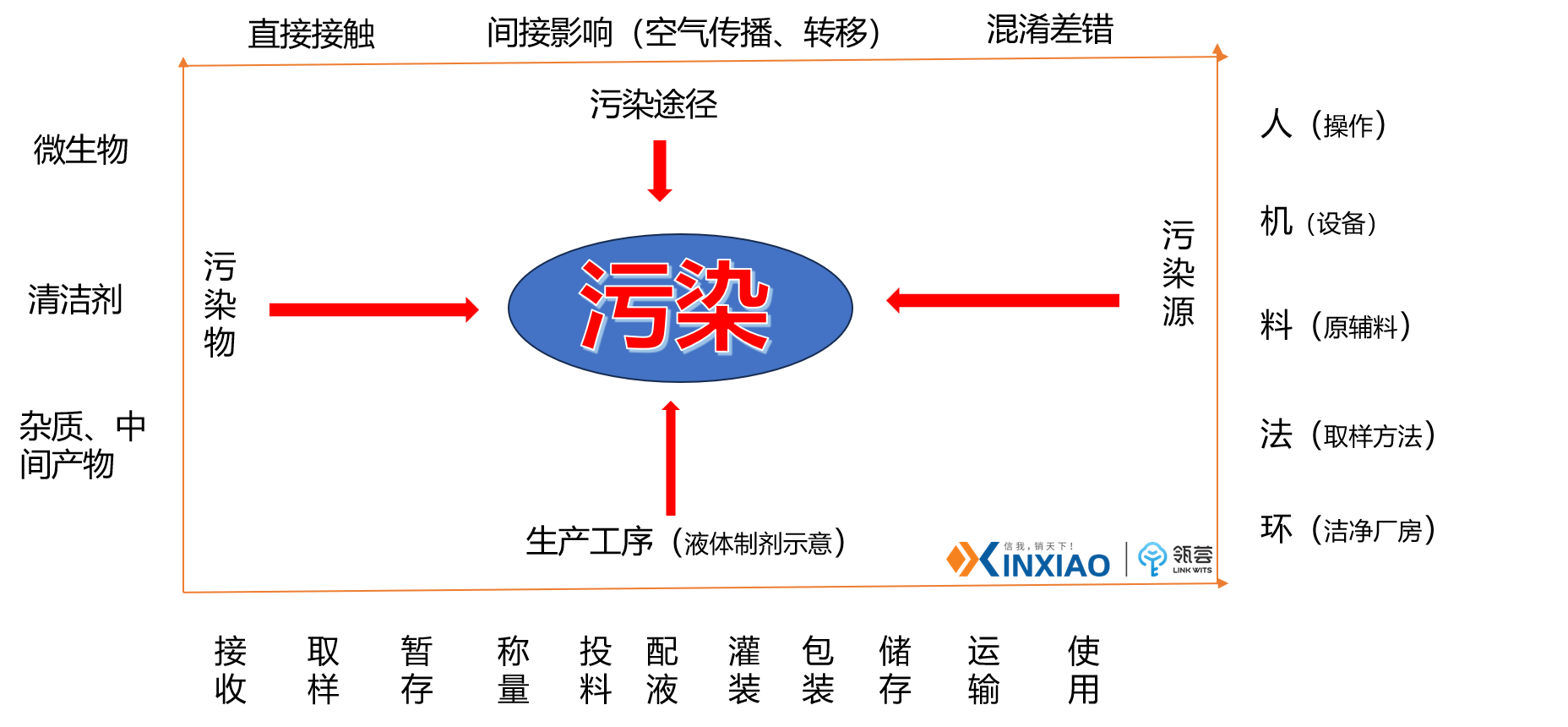
如何避免清洁验证产生缺陷
基于质量源于设计理念,科学合理的清洁验证设计
完善的清洁验证应当包括以下几个关键要素:最差条件的选择(如最难清洁的产品、最低清洁剂浓度等)、科学合理的取样方法(包括最难清洁部位的取样)、灵敏且专属的分析方法、以及合理的接受标准。
部分企业试图使用单一方法进行残留量的计算或者是系数选择不当,这些做法虽然可能简化了日常操作,但却牺牲了科学性和准确性,是典型的"走捷径"行为,后期可能会给清洁验证工作带来较大的风险。
清洁验证文件体系要完整,操作与SOP保持一致
清洁验证的目的、规定验证如何执行,认可的残留限度如何批准、什么样的情况下需要再验证,这些都是需要在清洁验证文件体系中需要编写的内容。

完善人员培训及考核机制
有效的培训和员工的合规意识是确保企业在清洁验证过程大幅降低风险。
可以建立管理层、技术层、操作层三级培训体系。对管理层进行法规解读和质量管理理念培训,使其掌握国内外法规最新的要求;技术层参加清洁验证方案设计、先进分析方法等专业培训;操作层重点学习清洁 SOP 和实际操作技能。
企业培训需要设计好培训考核的要求,同时还包括奖罚机制,除理论培训外,一定要组织实操的培训与考核,以确保员工时刻牢记标准要求。
另外,企业开展共线生产时一定要慎重,需要完善的清洁验证策略来确保产品不产生交叉污染与混淆。
规避合规风险是企业最好的降本增效,国际化合规也是中国药企走向国际的基础,希望我国各大药企从做好清洁验证开始,不再因清洁验证的问题被FDA发布警告信。
如果您的企业正面临清洁验证的挑战,可以垂询瓴荟智库中心的专家。

