8月1日,FDA专门针对原料药(API)生产设施的现场检查,更新了《原料药工艺检查》指南。本次API检查指南的修订内容比较多,篇幅由原来的30页增加到41页。
中国原料药企业,一定要引起重视。
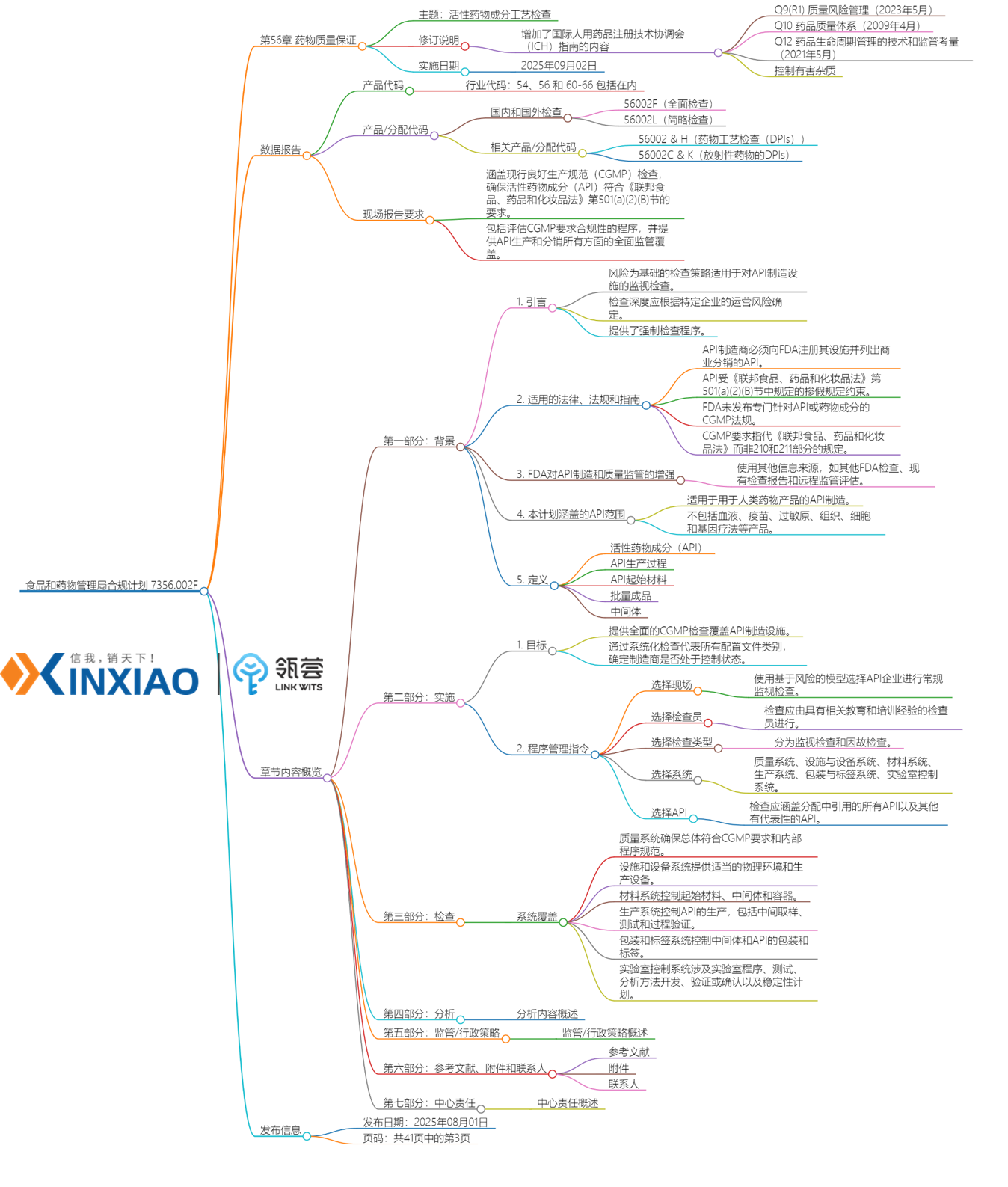
新增内容:拓宽API相关定义新版《原料药工艺检查》指南引入21 CFR 210.3(b)(7)法定定义,同时明确了API起始物料、散装成品和中间体等易混淆的概念。
API:任何旨在为诊断、治疗、缓解、预防疾病或影响人体或其他动物身体结构或功能的成分,都属于药物成分。该术语包括在药品制造过程中可能发生化学变化并以修改形式存在于药品中以提供指定活性或效果的成分。
原料药起始材料:用于生产原料药的原始材料、中间体或原料药,并且作为原料药结构中的重要结构片段被整合。原料药起始材料可以是商品,根据合同或商业协议从一个或多个供应商处购买的物料,或内部生产的物料。活性药物成分的起始材料通常具有明确的化学性质和结构。
散装成品:一种与原料药制造方式相似的药物材料,但在其合成、发酵或提取后不再进行进一步加工或混合,只是被重新包装。
中间体: 在API加工步骤中产生的,需要经过分子变化或纯化才能成为API的一类物质,这类物质可能会被分离出来也可能不会被分离。(仅涉及在设施确定为API生产开始点的点之后产生的中间体。)
监管框架升级,纳入最新的国际指南及远程监管辅助手段
新版《原料药工艺检查》指南整合了ICH Q9-Q12质量体系,形成了质量风险管理+生命周期管理相结合的新框架。
新指南的修订内容纳入国际人用药品注册技术协调会(ICH)行业指南Q9(R1)《质量管理风险管理》(2023年5月)、Q10《药品质量体系》(2009年4月)和Q12《药品生命周期管理的技术与监管考量》(2021年5月)要素。
除此之外,还新增了包括"远程监管评估"在内的辅助手段。
新版《原料药工艺检查》指南提及,FDA可能会使用其他信息来源来辅助监管。包括以下内容:(1)FDA进行的上市前和上市后的检查;(2)检查互认的外国监管合作伙伴的现有检查报告;(3)远程监管评估,包括根据《联邦食品、药品和化妆品法案》第704(a)(4)节直接从设施和其他受检实体请求的记录或其他信息和在适当情况下进行的远程交互评估。
质量要求强化,指南纳入亚硝胺控制,数据完整性问题明确为严重缺陷
质量体系新增亚硝胺等危险杂质控制要求。
新版《原料药工艺检查》指南要求参见《人用药品中亚硝胺杂质控制》(2024年9月)行业指南,对整个API生命周期中,记录、识别、评估、解决、沟通,并根据需要持续审查亚硝胺杂质的风险。
新版《原料药工艺检查》指南要求参见ICH 行业指南M7(R2) 评估有害杂质的危害风险,并实施控制策略以降低风险(例如,采取措施解决变异源,进行释放检测,减少或消除杂质,进行清洁验证);变更后以及在整个API生命周期中审查控制策略。
除此之外,新版《原料药工艺检查》指南将数据准确性和完整性缺陷列为严重缺陷。
新版《原料药工艺检查》指南提及数据应确保完整、一致和准确,包括可追溯、清晰、同步记录、原始或真实副本以及准确无误。数据完整性问题示例包括:未能科学地证明未报告相关数据的原因,篡改原始数据,制造操作记录不统一,测试结果倒签日期,测试符合性,以及伪造测试结果。无法确保数据准确性和完整性的示例包括:允许篡改或删除原始数据的系统、未激活审计跟踪的系统、未充分发布和复核的松散原始数据表单,以及对于数据完整性问题(所有系统)的基于风险的监测不足。