美国食品药品监督管理局(FDA)已加速批准罗氏公司的莫舒妥单抗(商品名:Lunsumio VELO)皮下注射制剂,用于治疗某些复发或难治性滤泡性淋巴瘤成人患者。

根据罗氏公司发布的新闻稿,这款CD20 × CD3双特异性抗体最初获批为静脉注射剂型,是首个用于既往至少接受过两线治疗的复发或难治性滤泡性淋巴瘤的药物。现在,其在相同适应症下获批可用于皮下注射给药。
罗氏指出,与静脉输注所需的2-4小时相比,皮下注射将治疗时间缩短至约1分钟。与静脉注射剂型一样,皮下注射剂型可在门诊环境中进行,并且是在规定时期内给予的固定疗程治疗。罗氏补充说明,“相比之下,‘治疗至疾病进展’的治疗方案设计为无限期地给予患者,直至疾病进展或无法继续耐受治疗。”
该药物的完全批准(可能取决于在确证性试验中验证其获益)基于针对复发或难治性非霍奇金淋巴瘤(包括滤泡性淋巴瘤)患者的1/2期G029781研究结果,该研究评估了静脉注射和皮下注射两种剂型。
皮下注射剂型的客观缓解率和完全缓解率分别为75%和59%。中位缓解持续时间为22.4个月。
发生在至少20%患者中的不良反应包括注射部位反应、疲劳、皮疹、细胞因子释放综合征(CRS)、SARS-CoV-2感染、肌肉骨骼疼痛和腹泻。30%的患者发生了CRS。大多数CRS事件为低级别,所有事件均在平均2天后缓解。

田纳西肿瘤学及OneOncology的医学博士Ian Flinn表示:“这一批准是在为滤泡性淋巴瘤患者扩大获得有效治疗途径方面迈出的重要一步。凭借其可控的细胞因子释放综合征特征和缩短的给药时间,Lunsumio VELO使得肿瘤学家能够在社区诊疗机构中提供先进的治疗。”
治疗复发或难治性滤泡性淋巴瘤(r/r FL)对全球患者而言都是一大挑战。在中国,这种疾病也带来显著的医疗负担。滤泡性淋巴瘤(FL)是中国常见的非霍奇金淋巴瘤之一。尽管发病率相对西方国家略低,占国内NHL患者的8.1%至23.5%,但其发病率呈逐年增加趋势。
值得关注的是,中国药企正在这一治疗领域快速追赶国际前沿,积极研发多种创新疗法,致力于为患者提供更多治疗选择。
下表梳理了国内药企在r/r FL领域的一些代表性研发进展:
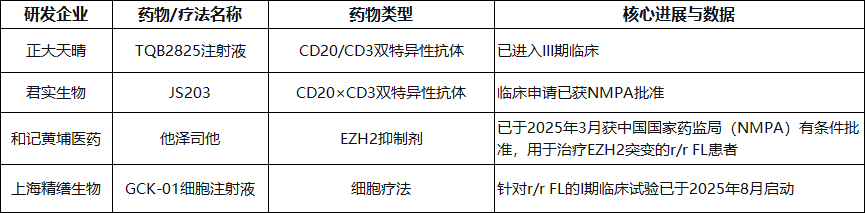
总结来说, 目前国内对于r/r FL的治疗格局正在迅速丰富。除了已获批的进口药物(如莫舒妥单抗)和国产EZH2抑制剂,更多由本土药企自主研发的、与国际热门靶点同步的双特异性抗体等疗法已进入临床中后期阶段。未来,随着这些研究的推进和成果转化,中国患者将有望获得更多高效、便捷的创新治疗选择。